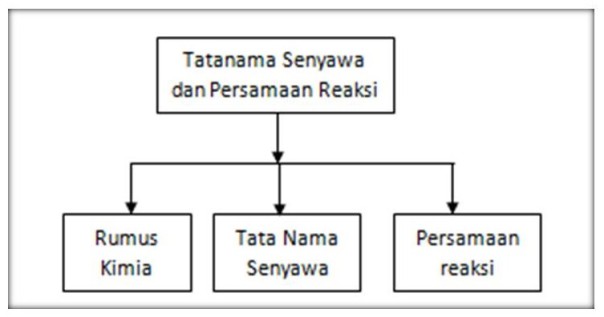
Peta konsep
A. Rumus Kimia
Rumus kimia zat menyatakan jenis dan jumlah relatif atom-atom yang terdapat dalam zat itu. Angka yang menyatakan jumlah atom suatu unsur dalam rumus kimia disebut angka indeks. Rumus kimia zat dapat berupa rumus molekul atau rumus empiris.
1. Rumus Molekul
Rumus kimia zat menyatakan jenis dan jumlah relatif atom-atom yang terdapat dalam zat itu. Angka yang menyatakan jumlah atom suatu unsur dalam rumus kimia disebut angka indeks. Rumus kimia zat dapat berupa rumus molekul atau rumus empiris
Contoh:
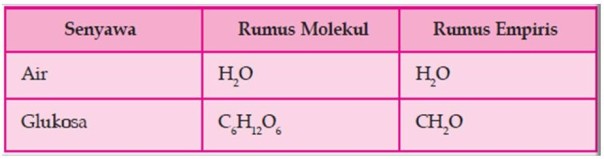
a. Rumus molekul air yaitu H2O yang berarti dalam satu molekul air terdapat dua atom hidrogen dan satu atom oksigen.
b. Rumus molekul glukosa C6H12O6 yang berarti dalam satu molekul glukosa terdapat 6 atom karbon, 12 atom hidrogen, dan 6 atom oksigen.
2. Rumus Empiris
Rumus empiris adalah rumus yang menyatakan perbandingan terkecil atom-atom dari unsur-unsur yang menyusun suatu senyawa. Rumus kimia senyawa ion merupakan rumus empiris.
Contoh:
a. Natrium klorida merupakan senyawa ion yang terdiri atas ion Na+ dan ion Cl– dengan perbandingan 1 : 1. Rumus kimia natrium klorida NaCl.
b. Kalsium klorida merupakan senyawa ion yang terdiri atas ion Ca2+ dan ion Cl– dengan perbandingan 2 : 1. Rumus kimia kalsium klorida CaCl2.
Pada kondisi kamar, sebagian unsur-unsur ada yang membentuk molekul-molekul. Rumus kimia unsur-unsur semacam ini tidak digambarkan hanya dengan lambang unsurnya, melainkan unsur beserta jumlah atom yang membentuk molekul unsur tersebut.
Contoh:
- Rumus kimia gas oksigen yaitu O2, berarti rumus kimia gas oksigen terdiri atas molekul-molekul oksigen yang dibangun oleh dua atom oksigen.
- Rumus kimia fosfor yaitu P4, berarti rumus kimia unsur fosfor terdiri atas molekul-molekul fosfor yang tiap molekulnya dibentuk dari empat buah atom fosfor.
Semua senyawa mempunyai rumus empiris. Senyawa molekul mempunyai rumus molekul selain rumus empiris. Pada banyak senyawa, rumus molekul sama dengan rumus empirisnya. Senyawa ion hanya mempunyai rumus empiris. Jadi, semua senyawa yang mempunyai rumus molekul, pasti memiliki rumus empiris. Namun, senyawa yang memiliki rumus empiris, belum tentu mempunyai rumus molekul.
Contoh:
Langkah-langkah menentukan rumus empiris dan rumus molekul sebagai berikut.
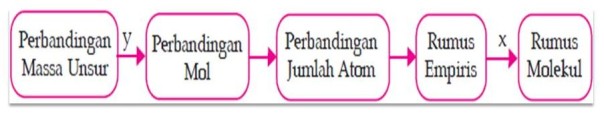
Keterangan:
y : massa unsur dibagi dengan Ar
x : dikalikan dengan hasil perbandingan dengan Mr rumus molekul dan Mr rumus empiris
B. Tatanama Senyawa
Nama ilmiah suatu unsur mempunyai asal-usul yang bermacam-macam. Ada yang didasarkan pada warna unsur seperti klorin (chloros = hijau), atau pada salah satu sifat dari unsur yang bersangkutan seperti fosfor (phosphorus = bercahaya) atau nama seorang ilmuwan yang sangat berjasa seperti einsteinium (untuk albert einstein). Untuk mencegah timbulnya perdebatan mengenai nama dan lambang unsur-unsur baru, Persatuan Kimia Murni dan Kimia Terapan (International Union Of Pure and Applied Chemistry = IUPAC) menetapkan aturan penamaan dan pemberian lambang untuk unsur-unsur temuan baru sebagai berikut.
1. Nama berakhir dengan ium, baik untuk unsur logam maupun nonlogam.
2. Nama itu didasarkan pada nomor atom unsur, yaitu rangkaian akar kata
yang menyatakan nomor atomnya.
0 = nil 4 = quad 7 = sept
1 = un 5 = pent 8 = okt
2 = bi 6 = hex 9 = enn
3 = tri
Lambang unsur (tanda atom) terdiri atas tiga huruf yakni rangkaian huruf awal dari akar yang menyatakan nomor atom unsur tersebut.
Contoh:
a. Unsur nomor atom 107
1 0 7
Un nil sept + ium
Nama : Unnilseptium Lambang : Uns
b. Unsur nomor atom 105
1 0 5
un nil pent + ium
Nama : Unnilpentium Lambang : Unp
Namun, aturan penamaan IUPAC jarang digunakan.
Ada beberapa sistem penamaan yang didasarkan pada rumus kimia senyawa.
1. Tatanama Senyawa Biner
Senyawa biner adalah senyawa yang hanya terbentuk dari dua macam unsur yang berbeda (terdiri atas unsur logam dan nonlogam).
a. Unsur yang berada di depan disebut sesuai dengan nama unsur tersebut.
- Unsur yang berada di belakang disebut sesuai dengan nama unsurtersebut dengan menambahkan akhiran -ida.
- Jumlah atom unsur disebut dengan menggunakan angka Latin (jika diperlukan).
Contoh:
NO : nitrogen monoksida
NO2 : nitrogen dioksida
AlCl : aluminium klorida
FeCl3 : besi(III) klorida
SnO : timah(II) oksida
Pada senyawa biner tersebut di atas, unsur logam sebagai kation (ion positif)
dan unsur nonlogam sebagai anion (ion negatif).
Tabel Beberapa Ion Positif (Kation)
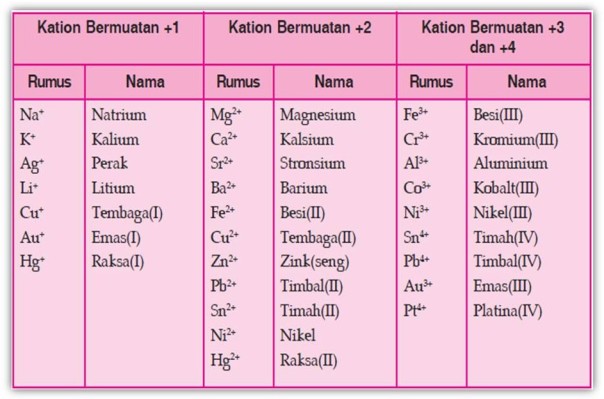 Tabel Beberapa Ion Negatif (anion)
Tabel Beberapa Ion Negatif (anion)
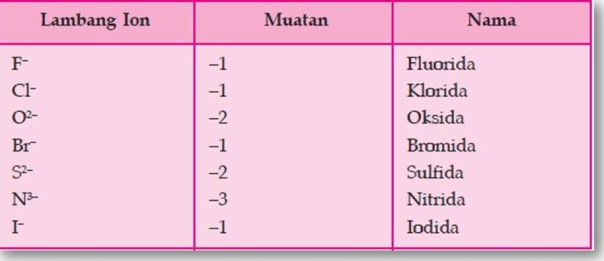
Apabila ion positif dan ion negatif bergabung membentuk senyawa, jumlah muatannya harus nol. Sebagai contoh:
- ion Fe3+ apabila bergabung dengan ion S2– akan membentuk senyawa dengan rumus kimia Fe2S3, sebab untuk menjadikan netral setiap tiga ion S2– yang mempunyai muatan –2 memerlukan 2 buah ion Fe3+ yang bermuatan +3,
- ion Al3+ apabila bergabung dengan ion Cl- akan membentuk senyawa dengan rumus kimia AlCl3 = Aluminium klorida, sebab untuk menjadikan netral setiap satu ion Al3+ yang bermuatan +3 memerlukan tiga ion Cl– yang bermuatan –1.
Perhatikan beberapa contoh berikut.
BaCl2 : Barium klorida
AgBr : Perak(I) bromida
CuCl2 : Tembaga(II) klorida
b. Senyawa Biner Kedua-duanya Nonlogam
Senyawa biner kedua-duanya nonlogam merupakan senyawa yang tersusun atas molekul-molekul, bukan ion-ion. Penamaannya ditandai dengan awalan angka Yunani yang menyatakan jumlah atom nonlogam diakhiri dengan akhiran –ida.
Awalan angka Yunani
Mono = 1 Heksa = 6
Di = 2 Hepta = 7
Tri = 3 Okta = 8
Tetra = 4 Nona = 9
Penta = 5 Deka = 10
Contoh:
CO : Karbon monoksida
CO2 : Karbon dioksida
N2O5 : Dinitrogen pentaoksida
PCl5 : Fosfor pentaklorida
SO3 : Belerang trioksida
3. Senyawa yang Tersusun Atas Ion-Ion Poliatom
Ion-ion dibedakan menjadi ion atom tunggal (ion monoatom) dan ion yang tersusun atas gabungan beberapa unsur yang disebut ion-ion poliatom. Cara pemberian nama senyawa yang tersusun atas kation dan anion poliatomik yaitu, nama logam kation diikuti nama anionnya. Khusus untuk logam golongan B disesuaikan dengan bilangan oksidasi unsur tersebut dalam senyawanya.
Contoh:
NH4Cl : amonium klorida
NaNO3 : natrium nitrat
MgSO4 : magnesium sulfat
KCN : kalium sianida
Zn(OH)2 : seng(II) hidroksida (pada senyawa ini, bilangan oksidasi seng = 2)
FeC2O4 : besi(II) oksalat (pada senyawa ini, bilangan oksidasi besi = 2)
Fe2(SO4)3 : besi(III) sulfat (pada senyawa ini, bilangan oksidasi besi = 3)
Tabel Beberapa Jenis Ion Poliatomik
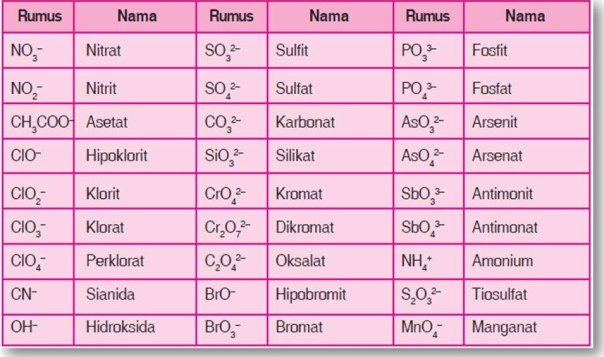
Hal-hal yang perlu diperhatikan dalam pemberian nama senyawa ion poliatomik sebagai berikut.
- Kebanyakan ion poliatom bermuatan negatif kecuali ion amonium (NH4+).
- Hampir seluruh ion poliatom mengandung oksigen, kecuali CN– dan NH4+. Untuk jumlah oksigen yang lebih sedikit diberi akhiran -it, dan untuk jumlah oksigen yang lebih banyak diberi akhiran -at. Contoh: SO3 2– diberi nama sulfit sedangkan SO4 2- diberi nama sulfat.
- Suatu senyawa bersifat netral. Oleh karena itu, apabila suatu senyawa belum netral, ion-ion yang berbeda muatannya harus disamakan terlebih dahulu dengan menambahkan angka indeks.
Contoh: - Ion Pb2+ dan NO3 . Oleh karena Pb bermuatan 2+ sedangkan NO3 bermuatan –1, untuk membentuk senyawa yang netral diperlukan 2 NO3 . Maka senyawanya menjadi Pb(NO3)2.
- Ion Ca2+ dan ion PO4 3-. Oleh karena Ca bermuatan +2 dan PO4 bermuatan –3, untuk membentuk senyawa netral Ca harus dikalikan 3 dan PO4 harus dikalikan 2. Maka senyawanya menjadi Ca3(PO4)2.
4. Tatanama Senyawa Asam
Asam adalah zat yang jika dilarutkan di dalam air akan terlarut dan terurai menghasilkan ion hidrogen (H+) dan ion negatif. Semua asam diawali dengan hidrogen kecuali asam organik dan air. Pada umumnya asam merupakan senyawa biner yang mengandung hidrogen, oksigen, dan unsur nonlogam. Semua asam dinamai dengan awalan asam yang diikuti nama ion negatifnya.
Tabel Beberapa Nama Asam

5. Tatanama Senyawa Hidrat
Beberapa senyawa yang berwujud kristal mampu mengikat air dari udara atau bersifat higroskopis, sehingga kristal senyawa tersebut mengandung “air kristal”. Senyawa yang mengandung air kristal disebut hidrat. Kristal hidrat tidak berair karena molekul air terkurung rapat dalam kristal senyawa. Senyawa hidrat dinamai dengan menambahkan awalan angka Yunani yang menyatakan banyaknya air kristal hidrat di akhir nama senyawa tersebut.
Contoh:
CuSO4.5H2O : tembaga(II) sulfat pentahidrat
CaSO4.2H2O : kalsium sulfat dihidrat
Na2CO3.10H2O : natrium karbonat dekahidrat
C. Persamaan Reaksi
Persamaan reaksi menggambarkan reaksi kimia yang terdiri atas rumus kimia pereaksi dan hasil reaksi disertai koefisiennya masing-masing. Persamaan reaksi yang sempurna disebut juga persamaan reaksi yang telah setara. Syarat-syarat persamaan reaksi setara sebagai berikut.
- Jenis unsur-unsur sebelum dan sesudah reaksi selalu sama.
- Jumlah masing-masing atom sebelum dan sesudah reaksi selalu sama (memenuhi hukum kekekalan massa).
- Perbandingan koefisien reaksi menyatakan perbandingan mol (khusus yang berwujud gas perbandingan koefisien juga menyatakan perbandingan volume asalkan suhu dan tekanannya sama).
- Pereaksi dan hasil reaksi dinyatakan dengan rumus kimia yang benar.
- Wujud zat-zat yang terlibat reaksi harus dinyatakan dalam tanda kurung setelah rumus kimia. Untuk membuat persamaan reaksi menjadi setaradiperbolehkan mengubah jumlah rumus kimia (jumlah molekul atau satuan rumus), tetapi tidak boleh mengubah rumus kimia zat-zat yang terlibat persamaan reaksi. Jumlah satuan rumus kimia disebut koefisien.
Selain menggambarkan rumus kimia, persamaan reaksi yang sempurna juga menunjukkan wujud zat yang terlibat dalam reaksi. Wujud zat dalam persamaan reaksi disingkat dengan:
(s) : solid (zat padat)
(l ) : liquid (zat cair)
(aq) : aqueous (larutan dalam air)
(g) : gas
Contoh: H2(g) + O2(g) –> H2O(l )
Contoh Soal
1. Tentukanlah koefisien reaksi dari asam nitrat dan hidrogen sulfida menghasilkan nitorgen oksida, sulfur, dan air. Persamaan reaksinya dapat ditulis: HNO3(aq) + H2S(g) à NO(g) + S(s) + H2O(l )
Jawab: Cara yang termudah untuk menentukan koefisien reaksinya adalah dengan memisalkan koefisiennya masing-masing a, b, c, d dan e sehingga:
a HNO3 + b H2S –> c NO + d S + e H2O
Berdasarkan reaksi di atas:
atom N : a = c (sebelum dan sesudah reaksi)
atom O : 3a = c + e –> 3a = a + e –> e = 2a
atom H : a + 2b = 2e = 2(2a) = 4a –> 2b = 3a –> b = 3/2 a
atom S : b = d = 3/2 a
Maka agar terselesaikan diambil sembarang harga misalnya a = 2 berarti: b = d = 3, dan e = 4 sehingga persamaan reaksinya:
2 HNO3 + 3 H2S –> 2 NO + 3 S + 4 H2O
Persamaan reaksi di atas dapat dibaca: dua senyawa asam nitrat dan tiga senyawa hidrogen sulfida akan menghasilkan dua senyawa nitrogen oksida, tiga atom sulfur, dan empat molekul air.
2. Serbuk besi direaksikan dengan larutan asam klorida menghasilkan larutan
besi(II) klorida dan gas hidrogen.
Jawab:
Reaksi yang berlangsung dapat ditulis:
Fe(s) + HCl(aq) –> FeCl2(aq) + H2(g)
Dari reaksi di atas dapat dilihat bahwa jumlah H dan Cl belum setara. Oleh karena itu, karena jumlah H dan Cl di sebelah kanan = 2 maka di sebelah kiri harus dikalikan 2 sehingga persamaan reaksinya menjadi:
Fe(s) + 2HCl(aq) –> FeCl2(aq) + H2(g)
:)
 ...
... gan...
gan...











